Hibridização
Hibridização ou hibridação é o conceito de misturar orbitais atômicos em novos orbitais híbridos (com diferentes energias, formas etc. do que os orbitais atômicos do componente) adequados para o emparelhamento de elétrons para formar ligações químicas na teoria das ligações de valência. Orbitais híbridos são muito úteis na explicação da geometria molecular e propriedades de ligação atômica e são dispostos simetricamente no espaço. Segundo o modelo da Teoria de Ligação de Valência (TLV), as ligação covalentes são formadas pela sobreposição de orbitais atômicos semipreenchidos (com apenas um elétron). A hibridização explica a formação de algumas ligações que seriam impossíveis por aquela teoria, bem como a disposição geométrica de algumas moléculas.
História e usos
O químico Linus Pauling desenvolveu a teoria da hibridação em 1931 para explicar a estrutura de moléculas simples como o metano (CH4) usando orbitais atômicos.[1] Pauling apontou que um átomo de carbono forma quatro ligações usando um e três orbitais p, de modo que "pode ser deduzido" que um átomo de carbono formaria três ligações em ângulos retos (usando orbitais p) e uma quarta ligação mais fraca usando o s orbital em alguma direção arbitrária. Na realidade, o metano possui quatro ligações de força equivalente separadas pelo ângulo de ligação tetraédrica de 109,5 °. Pauling explicou isso ao supor que, na presença de quatro átomos de hidrogênio, os orbitais s e p formam quatro combinações equivalentes ou orbitais híbridos, cada um indicado por sp3 para indicar sua composição, que são direcionadas ao longo das quatro ligações C-H. Esse conceito foi desenvolvido para sistemas químicos simples, mas a abordagem foi aplicada mais amplamente e hoje é considerada uma heurística eficaz para racionalizar as estruturas de compostos orgânicos. Ele fornece uma imagem orbital simples equivalente às estruturas de Lewis.
Hibridização do Carbono
O carbono é o elemento central da química orgânica e responsável pela complexidade das moléculas orgânicas,[2] pela variedade de ligações químicas e pela capacidade de formação de quatro ligações covalentes.[3]
A configuração eletrônica do carbono no estado fundamental é 1s2 2s2 2p2, e nesta configuração seriam possíveis apenas duas ligações covalentes, uma vez que existem apenas dois elétrons desemparelhados. Entretanto, a molécula de metileno (CH2) é extremamente reativa e não é estável. Para explicar a tetravalência do carbono, é usado o recurso da hibridização, "somando" as funções de onda dos orbitais 2s e 2p, resultando em orbitais híbridos.

Hibridização sp3
A construção da hibridização sp3 para o carbono se dá pela "promoção" e "mistura" dos orbitais 2s e 2p. Considerando o estado fundamental:
(Nota: O orbital 1s tem menos energia que o 2s, que por sua vez tem menos energia que os orbitais 2p)
Dessa forma, o carbono deveria realizar apenas duas ligações, ao que há apenas dois orbitais semipreenchidos. O primeiro passo para se entender o processo de hibridação, é excitar o átomo de carbono em questão, passando o elétron do orbital 2s para o 2p:

O passo seguinte é a mistura ou soma dos orbitais, dando origem a orbitais de energia intermediária entre 2s e 2p, dando origem ao orbital sp3 (lido s-p-três), assim chamado por ser o resultado da fusão de um orbital s com três orbitais p. Portanto, tem-se:
Agora o átomo de carbono está pronto para se combinar com quatro ligantes, compartilhando os elétrons desemparelhados. As ligações formadas têm a geometria cilíndrica em relação ao eixo internuclear, e são chamadas de ligações s (sigma). A geometria cilíndrica permite a rotação dos átomos sem que a ligação seja rompida.
Hibridização sp2
A hibridação sp2 é considerada quando um dos orbitais p não é somado aos orbitais híbridos, o que acontece em moléculas como a de eteno (H2C=CH2), na qual há ligação dupla entre carbonos. Um dos orbitais (por exemplo, py) é mantido "puro", para a construção da ligação dupla com o outro carbono. Este recurso é utilizado porque os orbital p puro tem a geometria adequada para a sobreposição com outro orbital p com a mesma geometria do outro carbono.
Seguindo o esquema promoção - mistura, a distribuição eletrônica do carbono resultaria:
Com esta configuração, são formadas três ligações s e uma ligação p (pi), cuja geometria não é cilíndrica e a rotação em torno do eixo internuclear resulta na ruptura da ligação química.
Hibridização sp
A ligação química em compostos como alcinos com ligações triplas é explicada por hibridação sp. Nesse modelo, o orbital 2s é misturado com apenas um dos três orbitais p,
resultando em dois orbitais sp e dois orbitais p restantes. A ligação química no acetileno (etino) (C2H2) consiste na sobreposição sp-sp entre os dois átomos de carbono formando uma ligação σ e duas ligações π adicionais formadas pela sobreposição p-p. Cada carbono também se liga ao hidrogênio em uma sobreposição de σ s – sp em ângulos de 180 °.
Cada tipo de hibridização do carbono acarreta em uma diferente geometria ao redor do átomo do carbono, podendo esta ser tetraédrica (sp³), trigonal plana (sp²) ou linear (sp), possuindo assim um ângulo entre os ligantes de, respectivamente, 109°28', 120° ou 180°.
Acidez de compostos orgânicos e hidribidização
O percentual da contribuição do orbital s varia conforme a hidridização, para sp = 50 %, sp2 = 33 % e sp3 = 25% e esta variação é apontada como a causa da maior eletronegatividade dos orbitais sp em relação aos outros,[4] uma vez que os elétrons do orbitais s são mais atraídos pelo núcleo. Esta seria a causa para a maior acidez hidrogênios ligados a carbono sp, uma vez que a carga negativa formada após a saída do próton seria mais estável em alcinos do que em alcenos e alcanos.
| função orgânica | alcano | alceno | alcino |
|---|---|---|---|
| caráter s | 25 | 33 | 50 |
| pKa do hidrocarboneto | 50 | 44 | 25 |
Quadro de hibridizações

A hibridização tem sido utilizada para explicar a formação de compostos covalentes para outros elementos, além do carbono. Para metais de transição, estão disponíveis orbitais d para a hibridização, o que resulta em outras possibilidades, como sp2d, sp3d2, conforme a tabela abaixo:
| Classificação | Grupo principal/
Metal de transição |
Metais de transição | |
|---|---|---|---|
| hibridização spx | hibridização sdx | hibridização spxdy | |
| AX2 |
|
||
| AX3 |
|
|
|
| AX4 |
|
|
|
| AX6 |
|
| |
Acredita-se que ligações hipervalentes podem ser descritas como orbitais híbridos sp³d e sp³d² compostos de orbitais s, p, e d em níveis de energia mais altos. Entretanto, avanços no estudo de cálculos ab initio têm revelado que a contribuição dos orbitais d para a ligação hipervalente é demasiado pequena para descrever as propriedades das ligações, e essa descrição de orbitais híbridos é agora considerada como muito menos importante.[5][6] Essas moléculas usam ressonância.
| AX5 | bipirâmide trigonal |
|---|---|

| |
| AX6 | Octaédrica |
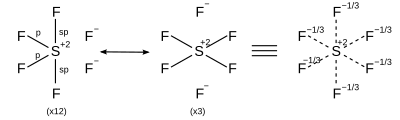
| |
| AX7 | bipirâmide pentagonal |
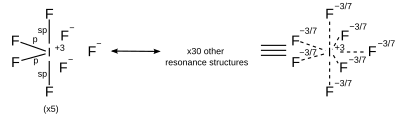
|
Referências
- ↑ Pauling, Linus. (abril de 1931). «THE NATURE OF THE CHEMICAL BOND. APPLICATION OF RESULTS OBTAINED FROM THE QUANTUM MECHANICS AND FROM A THEORY OF PARAMAGNETIC SUSCEPTIBILITY TO THE STRUCTURE OF MOLECULES». Journal of the American Chemical Society (em inglês). 53 (4): 1367–1400. ISSN 0002-7863. doi:10.1021/ja01355a027
- ↑ Lazzarotto, Márcio (2019). Química Orgânica Fundamental. [S.l.]: amazon
- ↑ Bruice, Paula Yurkanis, 1941- (2001). Organic chemistry 3rd ed ed. Upper Saddle River, N.J.: Prentice Hall. OCLC 44425438
- ↑ "Acids and Bases". Orgo Made Simple
- ↑ Magnusson, E. (1990). "Hypercoordinate molecules of second-row elements: d functions or d orbitals?". J. Am. Chem. Soc. 112 (22): 7940–7951. doi:10.1021/ja00178a014
- ↑ David L. Cooper; Terry P. Cunningham; Joseph Gerratt; Peter B. Karadakov; Mario Raimondi (1994). "Chemical Bonding to Hypercoordinate Second-Row Atoms: d Orbital Participation versus Democracy". Journal of the American Chemical Society. 116 (10): 4414–4426. doi:10.1021/ja00089a033













